Preimplantasyon genetik screening (PGS) tanım olarak preimlantasyon genetik tanı(PGD) yi içine alan kavramdır. PGD tanımı ise tek gen ya da önceden bilinen bir genetik hastalığın embriyoda taranması esasına dayanır. Preimplantasyon genetik tanının ilk uygulanmaya başlandığı 1990 yıllardan bu yana genetik tarama ve tanı platformlarında çok hızlı gelişmeler yaşanmaktadır. İlk PGD uygulamalarında biyopsiler polar body ve clivaj evre embrio biyopsisi şeklinde iken bugün günümüzde 5.gün embriyo trofoektoderm biyopsileri altın standart hale gelmiştir.
PGD-A; Preimplantasyon genetik anöploidi taraması
PGD-M; Preimplantasyon Mendelian tek gen taranması
PGD-SRM; Preimplantasyon yapısal kromozomal bozuklukların (Translokasyon-delesyon-duplikasyon-inversion) taranmasını ifade eder.
Başlangıçta; alınan biyopsiler FISH(PGS 1.0) tekniği ile incelemeye alınmıştır. FISH kısıtlı sayısa kromozom sayısı tarayabilen kendi içinde kısıtlamalara sahip bir testtir. takiben comparative genomic hibridizsyona dayalı array-microarray(CNV dayalı inceleme) ve komplex PCR dayalı değerlendirmeler hızla kulanılmaya başlanılmıştır. Micro-array ve komplex PCR sonuçları biribirine yakındır. Yakın amanlarda ise "Sinle Nucleotid Polimormizm" diğer adıyla "Next Generation Sequencing"(PGS 2.0) kullanıma girmiştir. NGS ile çok küçük miktarda DNA üzerinden çok detaylı taramalar mümkün olmaya başlamıştır. Takib eden süreçte nanopor sekanslama biildirlmiş olup 2 saat gibi bir sürede embriyoda hem tek gen heöm naöploid hemde yapısal bozukluklar taranabilmektedir. Ayrıca "extendent preimplantation genetic screning"(e-PGS) ile poligenic hastalıklar da taranabilir halde olup etik açıdan sorgulanmaktadır. Bu konu ile bağlantılı bir diğer gelişmede CRISPI-9 sistemi ile embrioda gen terapisinin mümkün hale gelmiş olmasıdr.
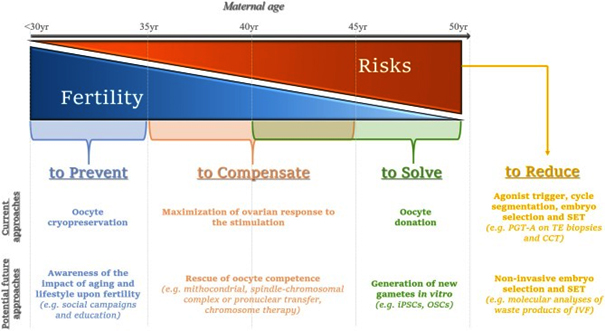
Tüp bebek hastalarında preimplantasyon genetic tarama ESHRE tatafından iki gruba ayrılmıştır;
1.Grup: High Risk grubu olup bu grupta Mendelian tek gen hastalıkları ve parental yapısal kromozamal bozuklukların taranması yer almaktadır.
2.grup:Low Risk grubu olup bu grupta advanced maternal age(AMA)-ileri anne yaşı-durumlarındaki preimlantasyon genetik taramayı kapsamaktadır.
Tüp bebek hasta grubunda 1.grupta yani yüksek risk gruplu hastalarda preimplantasyon tarama yapılması konusunda herhangi bir tartışma yoktur. Ancak 2.grup yani ileri anne yaşına bağlı infertil hastalarda preimplantasyon genetik tanı yapılması halen tartışmalı olmakla birilkte tüm dünyada tüp bebek sikluslarında kullanımı giderek artmaya başlamıştır.
AMA ya bağlı PGS uygulamalarında implantasyon oranları artmış, düşük oranları azalmış, çoğul gebelik azalmış ve hastanın sağlıklı gebeliğe ulaşma zamanı kısalmıştır. Ancak ilk çalışmaların sonuçlarına göre kümulatif canlı doğum oranları artış göstermemiştir. Bu durum ileri yaşa bağlı PGS uygulamalarındaki anöploidi taramalarının kalitatif değil kantitatif olduğu tartışmalarını da beraberinde getirmiştir (The CLBR is indeed dependent on the intrinsic predisposition of all the embryos obtained after IVF to implant and of the patient to carry a gestation, and aneuploidy testing cannot confer reproductive competence but only provide a tool to estimate such competence. In other terms, in theory, the number of babies born from a cohort of oocytes collected after COS should be the same if aneuploidy-testing is conducted or not, but preventing aneuploid embryos from being transferred should involve a shorter time to reach a pregnancy, a lower risk for miscarriage and a minimal residual risk for vital chromosomal syndromes in the fetus ). Yakın zamanda yapılan bir çalışmada öploid blastokist transferi yapıldığında hastanın yaşı ne olursa olsun %50 implantasyon oranlarının başarılmış olmasıyla birlikte bu konuda olumlu yönde görüş değişiklikleri başlamıştır. Ayrıca yeni birkaç çalışmada kümulatif canlı doğum oranlarında artış bildirilmiştir. Konu ile ile ilgili randomize prospektif çalışma olmaması, hasta gruplarındaki heterojenite(yaş ve over rezervi) ESHRE ve ASRM nin bu konuda halen temkinli yaklaşmasına neden olmaktadır. Ancak pratikte giderek AMA ya bağlı infertil olgularda PGS 2.0 kullanımın yaygınlaştığını da söyleyebiliriz.Ayrıca tekrarlayan gebelik kayıpları ve tekrarlayan tüp başarsızlığı olan hastalarda PGD-A nın sonuçlara olumlu katkısı gösterilememiştir. Normal ovarian reserve sahip genç hasta grubunda day5 blast trofoektoderm biyopsi ve micro-array platform kullanılarak "comprehensive chromozamal screening(CSS)"taramaları kümülatif canlı doğum oranlarını arttırmıştır ancak bu durum henüz ileri yaş hastalar için netlik kazanmamıştır.Yakın zamanda bildirilen birkaç çalışma sonuçlarına göre özellikle 37-41 yaş aralığında PGD-A uygulaması kümulatif canlı doğum oranlarda arttırıcı etki sağlamaktadır.
Blastokist trofoektoderm biyopsi uygulamasında ortalama 5-10 arası hücre alınmaktadır. Blastokist aşamasında olan embriyodaki toplam hücre sayısı 200'dür. Dolasıylada biyopsi ile embriyo bütünlüğü bozulmamaktadır. Ancak blastokist biyopsi incelemelerindeki en büyük sorun mozaism sorunudur. Mozaism olan embriolarda oran %20 ye kadar normal kabul edilmektedir. Mosaizmimn nedeni açık değildir.İn vitro kültür koşullaraı, ıvf tedavileri, biyopsi uygulamalarında hücre bütünlüğünün bozulması, embrioyaya agresif müdahaleler, laser yada mekanik uygulamalar esnasında hücrelerin parçalanması bu duruma yol açıyor olabilir. Tüm bunlara rağmen blastokist biyopsi ve micro array-NGS (PGS2.0) gold standart olarak kabul edilmektedir.
Genetik test yapılmamış 2 blastokist transferi ile incelemesi yapılmış öploid blast taransferi sonrasında gebelik oranları aynıdır. Ancak iki blast verilen grupta çoğul gebelikler ve bunların ortaya çıkardığı perinatal ve obstetrik kötü sonuçlar daha fazladır.Öploid blast transferi yapılan gruplarda düşük ve çoğul gebelik oranları dramatik düşmüştür.Tüp bebekte PGD-A uygulamaları hala tartışmalı olarak devam etmektedir. Konu ile ile ilgili çok hasta sayılı randomize prospektif çalışmaların sonuçları ile netlik kazanacak gibi görünmektedir.

Non invaziv PGD
Blastokist trofoektoderm biyopsisinin tüm embrionik hücreleri yansıtmaması, invaziv olması ve mosaizim problemleri alternatif testlerin kullanıma girmesine neden olmuştur. Blastosentesiz ile blast sıvısında inceleme yada kültür mediumundan cell free DNA incelemeleri henüz dvam etmekte olup olumlu sonuçlar bildirilmektedir.
Sonuç olarak; tekrarlayan IVF başarısızlığı hala gündemdeki yerini korumaktadır. Öploid blast transferinde her yaş grubunda %50 implantasyon oranları PGD-A uygulamalarını teşvik edicidir.PGD-A uygulanan laboratuarların blastokist kültür, biyopsi ve vitrifikasyon koşulları optimal olmalıdır. Karar vericilerin hastanın durumuna göre ve literatür sonuçlarını gözönüne alarak hareket etmeleri tavsiye edilmektedir.
Sağlıklı Günler Dilerim
Saygı ve Sevgilerimle
Doç Dr Cemil Kaya